深圳先进院揭示调节NK细胞抗肿瘤功能的新型卡控点分子
9月15日,中国科学院深圳先进技术研究院合成所田志刚课题组的最新研究成果以TIPE2 is a checkpoint of natural killer cell maturation and antitumor immunity为题在线发表于Science Advances杂志。论文报道了TIPE2分子负调控NK细胞的功能成熟与抗肿瘤免疫应答,表明TIPE2是NK细胞的卡控点分子,提示靶向TIPE2可能促进基于NK细胞的肿瘤免疫治疗策略。深圳先进院毕嘉成副研究员和中国科学技术大学孙昊昱副教授为该文的通讯作者,毕嘉成副研究员同时是该文的第一作者。
当前免疫治疗的快速发展正在改变肿瘤的治疗范式,然而,并不是所有的患者都能从免疫治疗中受益。在应对实体肿瘤等情况下,免疫治疗仍面临有效性和安全性不足等问题。另一方面,在合成生物学理念与技术的影响与驱动下,当前的免疫治疗研究正往以工程化操控为主要特征的“合成免疫学”新阶段发展,旨在通过设计与构建新型合成免疫分子、合成免疫细胞等,对免疫应答进行理性操控,从而实现肿瘤等重大疾病的免疫治疗。而 “卡控点分子/ Immune Checkpoints”(对免疫系统具有重要调节作用的分子)作为合成免疫分子/细胞设计的基本元件,对其进行深入研究不仅能揭示免疫应答的调控规律,而且能提供工程化设计合成免疫分子/细胞的理论依据。因而,“卡控点分子”研究是当前“合成免疫学”研究的关键切入点。
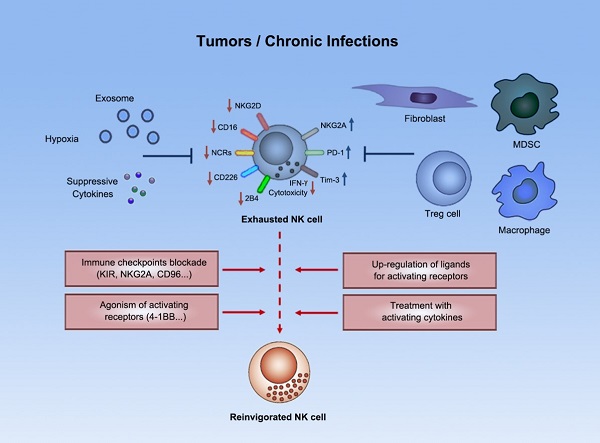
NK细胞(天然杀伤细胞,Natural Killer cells)是一种固有免疫细胞,通过杀伤靶细胞、诱导靶细胞凋亡或分泌细胞因子来发挥对肿瘤的免疫监视功能。大量研究早已显示NK细胞不仅在控制血液系统肿瘤及肿瘤转移中发挥关键作用,而且NK细胞在实体肿瘤中的浸润水平也与患者的预后密切相关。NK细胞在当前的肿瘤免疫治疗研究中具有重要的地位,因为NK细胞不仅能识别并杀伤HLA低表达等逃逸T细胞应答的肿瘤细胞类型,而且NK细胞对基于T细胞的免疫治疗(如靶向PD-1/PD-L1的“卡控点疗法”)也具有促进作用,此外NK细胞还天然具有作为“通用型”合成免疫细胞疗法底盘细胞的优势。尽管如此,NK细胞在肿瘤微环境中会受到一系列免疫抑制性细胞、分子等的负向调控,进入功能低下的“免疫耗竭”状态(图1);为了充分发挥基于NK细胞的免疫治疗策略的优势,我们需要深入揭示肿瘤相关NK细胞的功能调节机制。
课题组前期已发现表达在细胞表面的卡控点受体TIGIT(Hepatology 2014a,2014b; Nat Immunol 2018)和A3AR(Cell Mol Immunol 2021)在疾病状态如肿瘤、组织损伤与再生等过程中对NK细胞的功能具有负调控作用。在上述研究基础上,我们考虑到NK细胞在稳态条件下的成熟过程对于NK细胞最优功能水平的获得至关重要,而我们对该过程中的负调控因子了解不多,为了进一步探索NK细胞的潜在卡控点分子,我们对正常状态下人和小鼠外周NK细胞进行了单细胞转录组分析,结果显示NK细胞在功能成熟过程中存在着对应NK细胞从“不成熟”到“成熟”分化过程的几个亚群,我们同时发现,早前被报道具有介导免疫耐受功能的TIPE2分子伴随着NK细胞的成熟而逐渐表达升高(图2),呈现出与NK细胞成熟相关的表达特征。
我们通过NK细胞特异性缺失TIPE2的小鼠模型发现,NK细胞缺失TIPE2之后成熟亚群的水平升高、且NK细胞在群体水平和单个细胞水平均具有更强的效应功能(图3),表明TIPE2负调控了NK细胞的功能成熟过程。而且,我们进一步通过肿瘤模型发现,NK细胞缺失TIPE2之后显著抑制了肿瘤细胞在体内的生长,伴随着肿瘤浸润NK细胞水平的增加与功能分子表达水平的提高,从而表明TIPE2负调控NK细胞的抗肿瘤免疫应答(图4)。因此,我们通过这项研究发现,TIPE2是负调控NK细胞功能成熟与抗肿瘤免疫应答的卡控点分子,靶向TIPE2可能促进基于NK细胞的抗肿瘤免疫治疗策略。
该工作获得了科技部国家重点研发计划、国家自然科学基金、中国科学院定量工程生物学重点实验室、深圳合成生物学创新研究院等项目的支持。
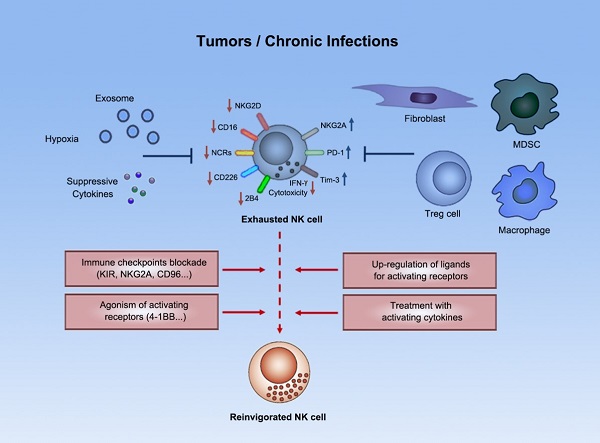
图1. NK细胞在肿瘤微环境中进入功能低下的“免疫耗竭”状态
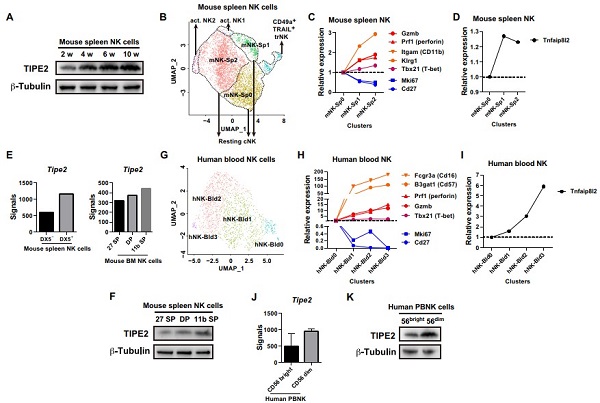
图2. TIPE2的表达水平与NK细胞的功能成熟相关
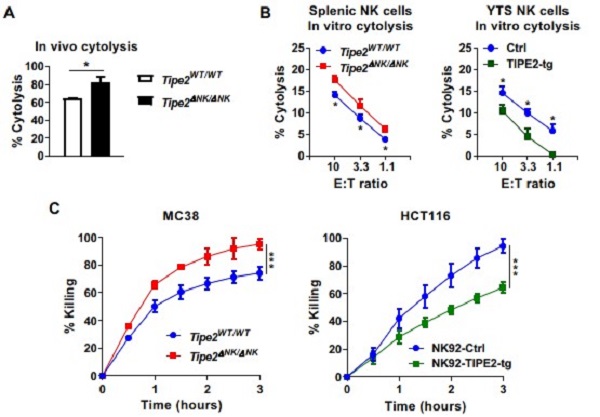
图3. TIPE2负调控NK细胞的效应功能
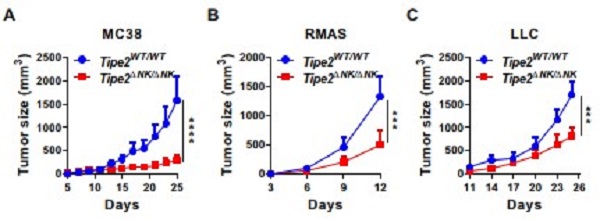
图4. TIPE2负调控NK细胞的抗肿瘤免疫应答